膵Perfusion CTとは
4.膵Perfusion CTにおける解析アルゴリズムの現状
膵へのPerfusion CTの応用の基礎的なアプローチは、Miles19やTsushima20、Abe21らにより精力的に行われてきた。最近では、Kishimotoら22により膵血流解析アルゴリズムにおける血管選択の重要性について、Sahaniら23により膵炎発症時における局所血流障害の診断能の正確性について、またTutcuら11により膵炎発症時の肝血流障害について、さまざまな解析モデルおよび動物モデルを用いた報告が続いている。
血流解析アルゴリズムとしてMaximumSlope法15,24、Deconvolution法21,25、Single Compartment kinetic model法26、Patlak法27がすい疾患へ応用されている(表1)。 こういった解析アルゴリズムは、各CTメーカーにより、販売されているものであるが、ワークステーステーション会社からも販売されている。本稿では、わかりやすくするために、もっとも古く、現在ほとんど使用されていない解析系を第一世代、現在すでに市販され、臨床において使用されている解析アルゴリズムを第2世代、臨床応用が試験的に始まり、論文報告されている解析アルゴリズムを第3世代と分類した。(表2)
第一回膵Perfusion CT研究会において、村上先生(近畿大学放射線科)よりこういったアルゴリズム群に関する大変詳細な解説が行われた(村上抄録)が、こうしたアルゴリズムの理解は、臨床応用においても重要である。過去には、インターネット上に詳細なアルゴリズムの説明を行ったものもあり、ぜひ御参照されたい。以下に主だったアルゴリズムの概論を提示する。(表2)
| アルゴリズム | 世代 | 市販の有無 (2010年9月現在) |
血流速度 | 血流量 | 組織通過時間 | 血流パターン |
|---|---|---|---|---|---|---|
| 1stmoment | 1 | ○ | - | - | Moment | - |
| Maximum Slope | 2 | ○ | PBF | PBV | Peak Time | R2 |
| Deconvolution | ○ | PBV | PBV | MTT | - | |
| Single compartment | 3 | × | FV | VD | ・ | R2 |
| Patlack | ×? | Kinput, Koutput | - | - | - |
1.1st moment法28
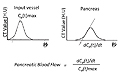
かつては、TDCにおけるPeak Time(図2)を組織通過時間に近い値として取り扱い、これをもって組織灌流(Perfusion)を議論していた。しかし、Peak Timeは造影剤の流入動態にのみ依存し、流出系の造影剤動態を拾い上げることができない。そこで、入出力にわたっての造影剤動態を解析するために、(1)一定時間のTDCを最小二乗法およびgamma-fittingによって関数化し、(2)この関数を造影剤動態の運動方程式であるととらえ、(3)この関数の重心を導き出し、これを組織のPerfusionとしてとらえる試みが行われた。この関数の重心(1st Moment)から算出される組織通過時間(図2、表3)は、現在もいくつかの市販のソフトに組み込まれ応用されている。しかしながら、大変重要なことに、1st Momentによる組織通過時間算出に関する数学的問題はすでに明らか28になっており、注意を払う必要がある。
図2 Time density curveの数学的解析
| 略称 | 表記 | 意味 | ||
|---|---|---|---|---|
| PH | Peak hight | K(α・β/e)n | ||
| AC | Area under curve | ∫ | ∞ T0 |
C(t)dt |
| AT(RT) | Aperance time | 造影剤が関心領域に出現するまでの時間 | ||
| PT | Peaktime | T0 + α・β | ||
| MT1 | 1st Moment(mean transit time) | ∫t・C(t)dt/∫C(t)dt = T0+β(α+1) | ||
| MT1E | Effective mean transit time | MT1-AT | ||
| MT2 | 2nd Moment | ∫t2 ・C(t)dt/∫C(t)dt - (MT1)2=β2(α+1) | ||
| TT | Transit time | 変曲点間の距離 | ||
| PM | PH-MT1E ratio | PH/MT1E | ||
| RF | Relative Flow | 相対的な流量 1/MT1E | ||
2.Maximum slope法
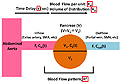
MaximumSlope法9,20,24は、膵実質におけるTDCデータ(Cp(t))の最大傾斜(dCp(t)/dt)を流入動脈(多くの場合は下大動脈)のTDCデータ(Ca(t))の最大高と比較することで、Pancreatic Blood Flow;PBFを解析する。(図3)この時、造影剤の急速投与中に流出血管より造影剤が流出しないことを前提としている。以下の式から算出される。
図3 Maximum slope法
この数式の前提が維持されるためには、造影剤のカーブは急峻であることが要求され(村上抄録)、造影剤投与速度の速さ(5~10ml/秒(10秒間))が大切である。以上から筆者らは、Maximum Slope法を急性膵炎に応用する際は、(1)5ml/秒以上で造影剤を投与すること、(2)可能な限り流入動脈を対象実質に近い部位に設定すること、(3)得られたデータを評価する際は、半定量的に評価すること、(4)心拍出量が低下しているような場合(元来低血圧である人や、ショック合併症例など)、造影剤のTDCの傾斜がなだらかになってしまう可能性があり撮像時の血圧に留意すること、以上(1)-(4)を心がけている。
3.Deconvolution法
Deconvolution法21,29は、流入血管と、対象実質、流出血管の間を、造影剤が漏れなく移行すると仮定する(村上抄録)。脳のように造影剤の滲み出しが存在しないような臓器では、全て漏れなく回収できるので、定量性を有していると考えられている。膵臓への応用における定量性については、Abeら21によると、Xeシンチグラフィーとの比較から、一定の定量性を有していると考えられる。Deconvolution法は、その計算の過程で,box-MTF法や、Block-circulant法といった血流モデルを想定した方法と組み合わせて展開される。以下の式からPBF、Pancreatic Blood Volume(PBV)、Mean transit Time(MTT)が算出される。
図4 Deconvolution(box-MTF)法
Meantransit time (MTT) =∫tR(t)dt/∫R(t)dt
Pancreatic blood volume (PBV) =∫R(t)dt
Pancreatic blood flow (PBF) = R(0)
伝達関数(MTF)=R(t)とする。
Deconvolution法はMaximumslope法と異なり、投与速度に依存しない。心拍出量が低いような場合であっても、Deconvolution法は安定した結果を提示する。 一方、滲み出しが著しい場合、定量性に影響が出る可能性があるが、我々の動物実験の結果では、膵実質における造影剤の滲み出しよりも、血管選択の影響の方が大きかった。以上から、Deconvolution法を膵に応用する際は、(1)流出血管と、流入血管を出来る限り評価したい膵実質の近傍に設定する、(2)定量性を追求する場合、門脈圧亢進や、シャント、腫瘍による血管のInvasionの有無に注意する、以上(1)、(2)を心がけている。
4.Single compartment kinetic model
Single compartment kinetic Modelは、One compartment Modelとも呼ばれている。造影剤は、輸入動脈および膵臓へ到達した時点で均一に混和されていること、さらに、造影剤が血流の豊富な実質(図5V1)から、非血管系(例えば壊死実質や間質、線維化の著しい部分)(図5V2)への移行が存在しないこと、以上2つの仮定の上に成り立っている。数学的な解析から、腹部臓器たとえば膵や小腸において、応用は可能であると報告されている。解析モデルの概念の成立は古いが、腹部臓器への応用は近年始まったばかりである。以下の式から、Fv、VD、τ、R2が算出される。
図5 Single compartment kinetic model
dm(t) / dt=[F・Cin (t - τ)] - [F・Cout (t)]
Cout (t) = [m(t)]/VandC1 (t) = [m(t)]/V1 = V/ V1・Cout (t)
dCout (t) / dt = [F / V・Cin (t - τ)] - [F / V・V1 / V・C1 (t)]
= [Fv・Cin (t - τ)] - [Fv・VD・C1 (t)]
Fv=F/V, VD=V1/V
5.その他
本法からの報告は未だないが、膵癌へのPatlack法を用いた検討の報告がある。このように、たくさんのアルゴリズムが存在し、さらに各社によっていろいろな性格がある。こういった違いを克服するために、今後のどのように標準化していくか、検討すべき時期が来ているように思う。